
题目列表(包括答案和解析)
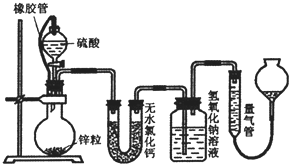 不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.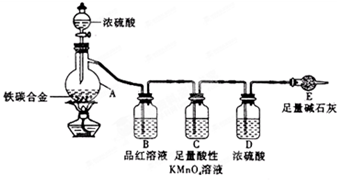 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.| △ |
| ||
| ||
| 3b |
| 11a |
| 3b |
| 11a |
(12分)请用下图的装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体从左到右的方向)是___________。(填各接口的编号)
(2)实验时甲仪器的作用与原理是____________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是________________________________。
(4)Ⅳ处观察到的现象是___________________________。
(5)在Ⅰ处用大火加热烧瓶时SO2的转化率会__________。(填“填大”“不变”或“减小”)
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为______________。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
(12分)请用下图的装置设计一个实验,以测定SO2转化为SO3的转化率。
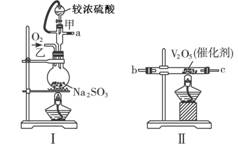

(1)这些装置的连接顺序(按气体从左到右的方向)是___________。(填各接口的编号)
(2)实验时甲仪器的作用与原理是____________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是________________________________。
(4)Ⅳ处观察到的现象是___________________________。
(5)在Ⅰ处用大火加热烧瓶时SO2的转化率会__________。(填“填大”“不变”或“减小”)
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com