
题目列表(包括答案和解析)
现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同。计算混和物中碳酸锂和碳酸钡的物质的量之比。
| ||
| ||


| ||
| ||
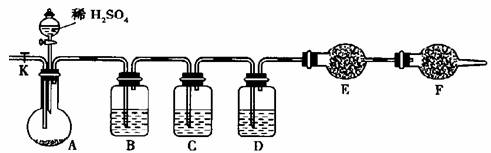
为测定Na2SO3与Na2CO3的混合物中各组分的含量,取23.2g样品按下图装置(铁架台、铁夹等仪器在图中未画出)进行实验。已知C中装有品红溶液。
实验室备有的常见试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.饱和碳酸氢钠溶液e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰
(1)此实验缺少的最重要的仪器是 ;
(2)C的作用是 ,
F的作用是 ;
(3)请将下列容器中应盛放的试剂序号填入相应的空格:
B ,D ,F ;
(4)实验过程中,当A中的固体反应完全后,需打开活塞K,向A中通入大量的空气,这
样做的目的是 。所通
入的空气应先经过装有 试剂(从上述试剂中选,填序号)的洗气瓶处理,否则
可能引起Na2SO3的含量比实际值 。(填“偏高”、“偏低”或“无影响”)
(5)若仪器E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为 。
| ||
| △ |
| ||
| △ |

| △ |
| △ |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com