甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池.工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下.
反应Ⅰ:CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H
1反应Ⅱ:CO(g)+2H
2(g)?CH
3OH(g)△H
2 (△H
2<0=
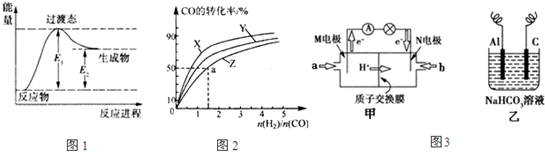
(1)图1是反应Ⅰ进行过程中的能量变化示意图.根据图象判断,升高温度,反应I的平衡常数将
(填“增大”、“减小”或“不变”).
(2)已知在催化剂和一定压强下,反应Ⅱ能自发进行.在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.
图2是上述三种温度下不同的H
2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是
;该温度下上述反应的化学平衡常数为
.
(3)图3甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH
3OH+3O
22CO
2+4H
2O.
①M电极的电极反应式为
.
②以上述电池做电源,用图3乙所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示):
.Al电极应接燃料电池的
(填“M”或“N”)极.
(4)合成甲醇时可选用CuCl为催化剂.CuCl是不溶于水的白色固体,制备时向CuCl
2溶液中加入过量铜粉,发生反应CuCl
2+Cu═2CuCl.在实验过程中应先加入浓盐酸,发生反应CuCl+HCl?H[CuCl
2].反应结束后将溶液倒入蒸馏水中有CuCl生成.实验过程中加入浓盐酸的目的是
.当c(Cl
-)=2×10
-3mol?L
-1时,c(Cu
+)=
mol?L
-1.已知:K
sp(CuCl)=1.7×10
-7.

