
题目列表(包括答案和解析)
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO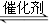 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
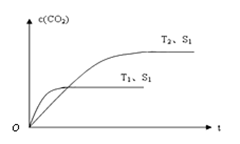
 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |


 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.Ⅰ.氮是地球上含量丰富的一种元 素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
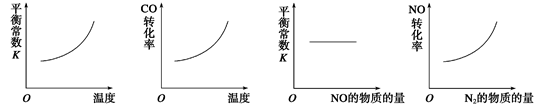
素,氮及其化合物在工农业生产、生活中有着重要作用。请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
 下列问题:
下列问题: 度的排列顺序正确的是 (填序号)。
度的排列顺序正确的是 (填序号)。 |
 。
。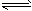 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com