
题目列表(包括答案和解析)
A.将足量的SO2通入棕黄色的FeCl3溶液中,最后溶液变为浅绿色
SO2+2FeCl3+2H2O====2FeCl2+H2SO4+2HCl
B.氯化亚铁溶液在空气中长期放置,会因氧化而产生红褐色浑浊现象
4FeCl2+O2+10H2O====4Fe(OH)3↓+8HCl
C.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯
3KClO3+6HCl(浓)====3KCl+2ClO2↑+2Cl2↑+3H2O
D.赤铜矿(Cu2O)和辉铜矿(Cu2S)混合加热可得铜
4Cu2O+Cu2S====10Cu+CuSO4
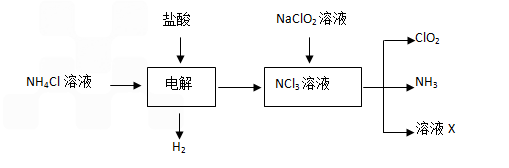
某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1) 写出并配平上述过程的化学方程式,并标出电子转移的方向和数目。
_____________________________________________________________
(2) 该反应中,盐酸体现了_______、_______性质。氧化剂是___________,反应后,若产生0.6mol气体,则转移电子的物质的量为___________mol。
(3) ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1) 写出并配平上述过程的化学方程式,并标出电子转移的方向和数目。
_____________________________________________________________
(2) 该反应中,盐酸体现了_______、_______性质。氧化剂是___________,反应后,若产生0.6mol气体,则转移电子的物质的量为___________mol。
(3) ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O.已知该反应中,KClO3发生了一个过程:KClO3→ClO2.ClO2是黄绿色易爆的气体.
(1)写出并配平上述过程的化学方程式,并标出电子转移的方向和数目.
________
(2)该反应中,盐酸体现了________、________性质.氧化剂是________,反应后,若产生0.6 mol气体,则转移电子的物质的量为________mol.
(3)ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com