
题目列表(包括答案和解析)
用符号“<”、“>”、“=”连接下列各项关系.
(1)金属性:Mg________Cs、Ge________Sn;
(2)非金属:N________As、F________S;
(3)酸性: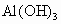 ________
________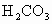 、
、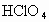 _________
_________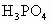 ;
;
(4)与水反应的剧烈程度Ca_________Mg、Be_________K;
(5)主族序数__________原子最外层电子数_________元素最高正化合价数.
用符号“<”、“>”、“=”连接下列各项关系.
(1)金属性:Mg________Cs、Ge________Sn;
(2)非金属:N________As、F________S;
(3)酸性: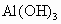 ________
________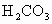 、
、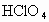 _________
_________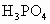 ;
;
(4)与水反应的剧烈程度Ca_________Mg、Be_________K;
(5)主族序数__________原子最外层电子数_________元素最高正化合价数.


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com