
题目列表(包括答案和解析)
实验室里,欲从草木灰中除去不溶于水的固体来提取固体碳酸钾.
(1)该实验操作的主要步骤排列顺序为(用字母表示)________.
(2)用实验证明提取的固体主要成分是K2CO3的方法是________.
(3)检验在粗制碳酸钾溶液中含少量Cl-的方法是________.
(4)要制得纯度更高的碳酸钾晶体的方法是________.
| ||
| ||

(10分)铝是一种重要金属:(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
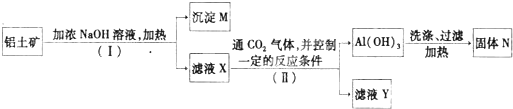
(2)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3 ,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是; ;
②沉淀M中除含有泥沙外,一定还含有 ,固体N是 ;
③滤液X中,含铝元素的溶质的化学式为 ,它属于 (填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入 (填“氨水”或“NaOH溶液”)来制取
A1(OH)3。其反应的离子方程式为:___________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com