
题目列表(包括答案和解析)
(1)表中所列元素中:
属于短周期元素的有_______;
属于主族元素的有_______;
e元素在元素周期表中的位置是_______周期,_______族。
(2)下列_______组元素的单质可能都是电的良导体。
A. a,c,h
B. b,g,k
C. c,h,l
D. d,e,f
(3)将元素a,c,d,f,l,b的原子半径按从小到大的顺序排列:_______。
(4)i元素属于_______(填“金属”或“非金属”)元素,它的最离化合价是_______,最低化合价是_______。它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出它与氧气反应的化学方程式:________。
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
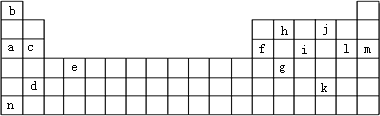
(1)e元素在周期表中的位置为________.画出g的原子结构示意图________.
(2)在上面元素周期表中画出金属元素与非金属元素的分界线.
(3)将元素a、f、h、b按原子半径从小到大的顺序排列________.(填元素符号)
(4)比较i和j形成的气态氢化物的稳定性________.(用化学式表示)
(5)比较i和l形成的最高价氧化物对应水化物的酸性________.(用化学式表示)
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
(1)表中所列元素中:
属于短周期元素的有_______;
属于主族元素的有_______;
e元素在元素周期表中的位置是_______周期,_______族。
(2)下列_______组元素的单质可能都是电的良导体。
A. a,c,h
B. b,g,k
C. c,h,l
D. d,e,f
(3)将元素a,c,d,f,l,b的原子半径按从小到大的顺序排列:_______。
(4)i元素属于_______(填“金属”或“非金属”)元素,它的最离化合价是_______,最低化合价是_______。它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出它与氧气反应的化学方程式:________。
(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。LinusPauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com