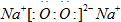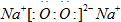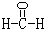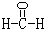A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族.A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C
2-离子含10个电子.
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
C
2H
2(g)+
O
2(g)=2CO
2(g)+H
2O(1)△H=-1300kJ/mol
C
2H
2(g)+
O
2(g)=2CO
2(g)+H
2O(1)△H=-1300kJ/mol
.
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
C2H2-10e-+14OH-=2CO32-+8H2O
C2H2-10e-+14OH-=2CO32-+8H2O
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
2I-+H2O2+2H+=I2+2H2O
2I-+H2O2+2H+=I2+2H2O
.
(6)E的一种氧化物与ClO
-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
.