某探究性学习小组用如图所示的装置和药品探究Cl
2的化学性质:
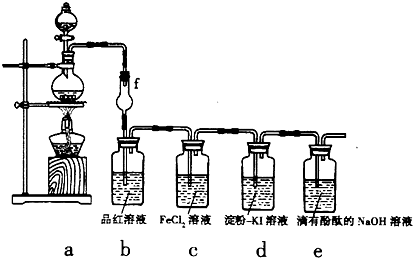
试回答下列问题:
(1)用图中a装置来制取Cl
2,则浓盐酸应放入a装置的
分液漏斗
分液漏斗
(填仪器名称)中.
(2)该实验方案存在的主要缺陷是
缺少尾气处理装置,易造成大气污染
缺少尾气处理装置,易造成大气污染
.
(3)①当a中产生足量氯气时,b装置内的现象为
溶液由红色变为无色
溶液由红色变为无色
,f装置的作用是
防止倒吸
防止倒吸
.
②c装置内溶液由浅绿色变为黄色,为检验c装置内生成的阳离子,某同学进行了如下实验:向反应后的溶液中先滴加KSCN溶液,溶液呈血红色,再向其中滴加过量的新制氯水时,发现溶液的血红色褪去.为了弄清溶液血红色褪去的原因,同学们查到如下资料:
Ⅰ.铁元素可形成铁酸盐(含有
Fe);
Ⅱ.SCN
-的电子式为
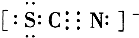
;
Ⅲ.氯水具有很强的氧化性.
于是同学们提出以下两种假设:
假设一:Cl
2可将Fe
3+氧化成
Fe,请写出该反应的离子方程式:
2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+
2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+
.
假设二:
SCN-被氯气氧化
SCN-被氯气氧化
,提出该假设的理论依据是
SCN-中S、N元素处于最低价态
SCN-中S、N元素处于最低价态
.欲探究上述假设是否成立,可设计的实验方案为
向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立
向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立
.


 ;
;