(2011?德州二模)I.为研究盛装浓硫酸的铁质材料(碳素钢)与热浓硫酸的反应,某学习小组进行了以下探究活动:
实验:称取铁钉5.6g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(l)甲同学认为X中除Fe
3+外还可能含有Fe
2+,若要确认其中的Fe
2+,应选用
d
d
(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO
4溶液
(2)乙同学取448mL (标准状况)气体飞通入足量溴水中,溴水褪色.写出反应的离子方程式:
Br2+SO2+2H2O═4H++2Br-+SO42-
Br2+SO2+2H2O═4H++2Br-+SO42-
.然后向所得溶液中加入足量BaCl
2溶液,经
过滤、洗涤
过滤、洗涤
干燥等实验操作步骤后称量得固体2.33g.由此推知气体Y中SO
2的体积分数为50%.
提出猜想:
II.分析上述实验中SO
2体积分数的结果,同学们认为气体Y中还可能含有其它气体并作如下猜想:
猜想一:Y气体中可能含有H
2;
猜想二:Y气体中可能含有CO
2;
猜想三:Y气体中可能含有H
2和CO
2设计实验,验证猜想:
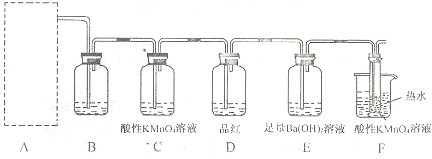
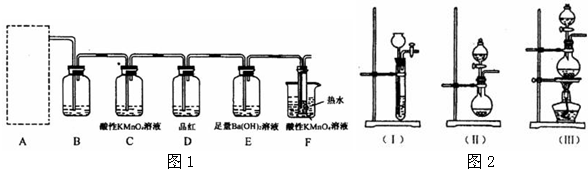
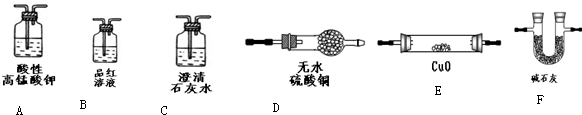
为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省略).
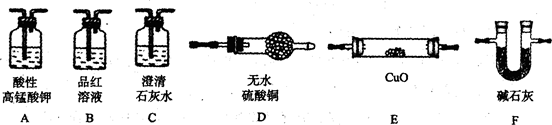
(l)实验装置的连接顺序为A→
B
B
→
C
C
→F→
E
E
→
D
D
→F (填字母).
(2)装置B中试剂的作用是
检验SO2是否除尽
检验SO2是否除尽
(3)猜想一的理由是
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
(用化学方程式表示).
(4)如果猜想一成立,预计按①中装置反应则可观察到得实验现象应为:
E中固体由黑变红,D中固体由白变蓝色
E中固体由黑变红,D中固体由白变蓝色
.