
题目列表(包括答案和解析)
某化工厂排出的废水含Cl2为0.014mo1·L-1、H+为0.001mo1·L-1,废水排 出的速度为10.0mL·s-1。为了除去此废水中的游离氯,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱液(0.10mo1·L-1)和Na2SO4溶液(0.10mo1·L-1)。
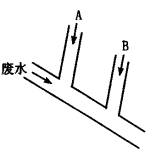
试回答:
(1)A处应注入________溶液,离子方程式为________;B处应注入________溶液,离子方程 式为_________。
(2)A处溶液的流量和B处溶液的流量分别应控制为多少(mL·s-1)?
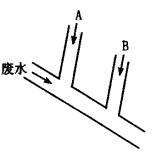
试回答:
(1)A处应注入________溶液,离子方程式为________;B处应注入________溶液,离子方程 式为_________。
(2)A处溶液的流量和B处溶液的流量分别应控制为多少(mL·s-1)?
某工厂排放出的废水,经测定含有0.001mol/L的游离氯(Cl2)和0.008mol/L的H+,现采用Na2SO3除去其中的游离氯,有关反应如下:
Na2SO3+Cl2+H2O=Na2SO4+2HCl
若要处理5L这样的废水.
(1)需加入0.5mol/LNa2SO3溶液多少ml,才能将Cl2全部除去?
(2)处理后的废水的PH是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com