
题目列表(包括答案和解析)
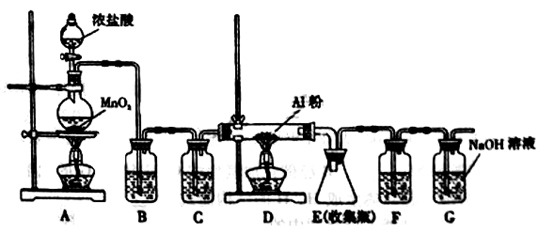
无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。

请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是 。
a.加入MnO2粉末 b.点燃A中酒精灯 c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的化学方程式: 。
(3)装置B和C中的试剂分别是 。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是 。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因 。
(6)制备过程中随着盐酸的浓度下降,氯气的制取反应会停止。为测定残余液中盐酸的浓度,某同学量取残余液10.00mL,加水稀释到250.00mL。然后从中取出20.00mL,用0.1000mol·L-1的NaOH标准溶液进行滴定,终点时消耗NaOH溶液24.00mL。则该残余液体中盐酸的浓度为 。
无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。
请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是 。
a.加入MnO2粉末 b.点燃A中酒精灯 c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的化学方程式: 。
(3)装置B和C中的试剂分别是 。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是 。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因 。
(6)制备过程中随着盐酸的浓度下降,氯气的制取反应会停止。为测定残余液中盐酸的浓度,某同学量取残余液10.00mL,加水稀释到250.00mL。然后从中取出20.00mL,用0.1000mol·L-1的NaOH标准溶液进行滴定,终点时消耗NaOH溶液24.00mL。则该残余液体中盐酸的浓度为 。
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2

①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:
回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com