
题目列表(包括答案和解析)
| ||
| ||
| 编号 | 装置的缺陷和不妥之处 |
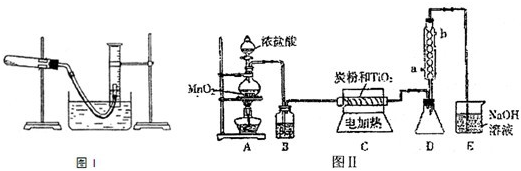
| a | TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置 TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置 |
| b | TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置 TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置 |
| … | 由于CO气体有毒,缺少CO的处理装置 由于CO气体有毒,缺少CO的处理装置 |
| ||
| ||
| △ |
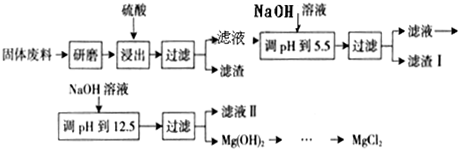
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
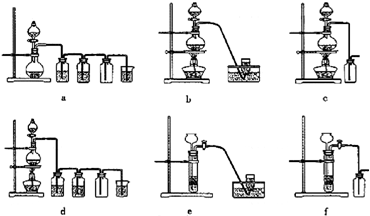
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.?
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.?
| ||
| ||

| ||
| ||

| 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH | |
| Cu2+ Fe2+ Fe3+ |
4.7 4.0 1.9 |
6.7 9.0 3.2 |
(17分)实验室常用的几种气体发生装置如下图所示:

(1)现用两种方法来制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2。
第一种方法是选择装置图2,则需选用的试剂为:______________________;第二种方法是选择装置图3,则需选用的试剂为:_____________________________。
(2)若把装置图1与装置图4相连,在实验室可用来制取下列气体中的_________(填序号)。

①CH2=CH2 ②NO ③Cl2 ④C2H2 ⑤NH3
制取这种气体时,除选用(1)所提供的几种药品外,还需要的一种试剂是___________。
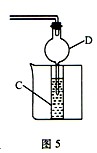
(3)若把装置图3与装置图5相连,进行实验,将溶液A逐滴加入试剂E中;溶液恰好澄清时,关闭B,然后往烧杯中加入热水,静置片刻,观察到试管内壁出现光亮的银镜,则溶液A是 ___________(写名称),C是__________(写化学式)与乙醛(或葡萄糖)的混合液。该反应的离子方程式为_____________________,仪器D在此实验中的作用是__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com