
题目列表(包括答案和解析)
(1)计算CO和CO2的质量分数。
(2)计算CO和CO2的体积分数。
(3)指出两种气体不可能共存时的碳和氧质量之比。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。 CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | | |
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
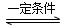 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。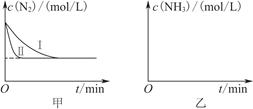
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+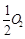 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。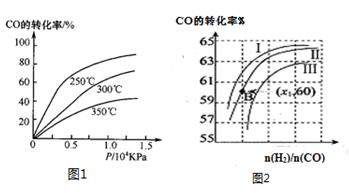
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。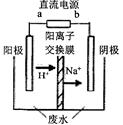
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。 CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol[学科 | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。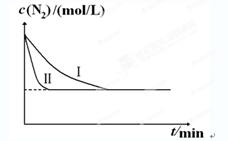

碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)已知:C(s)+CO2(g) 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)__________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
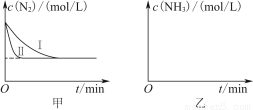
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com