
题目列表(包括答案和解析)
将纯铁丝5.21g溶于过量的稀硫酸中,在加热条件下用2.53g KNO3去氧化溶液中的Fe2+,待反应完全后,剩余的Fe2+尚需12.0 mL 0.3 mol·L-1的KMnO4溶液方能完全氧化(已知 的还原产物是Mn2+),请确定
的还原产物是Mn2+),请确定 的还原产物
的还原产物
[ ]
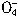 被还原为Mn2+),计算后确定N
被还原为Mn2+),计算后确定N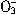 的还原产物为 ()。
的还原产物为 ()。| 高温 |
| 时间/min | 0 | 2 | 4 | t1 | t2 |
| n(SiCl4)/mol | |||||
| 温度/℃ | |||||
| T1 | 5.0 | 4.5 | 4.2 | n1 | n1 |
| T2 | 5.0 | 4.2 | 3.6 | n2 | n2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com