氯气是一种重要的化工原料.
(1)若用溶有7.3g HCl的浓盐酸与足量的MnO
2加热反应制得的Cl
2在标准状况下体积总是小于1.12L,除盐酸挥发外,还因为
.
(2)下列方法中,也可制得Cl
2的正确组合是
.
①MnO
2、NaCl和浓硫酸混合共热;②浓盐酸与浓硝酸混合;③NaClO和浓盐酸混合;④PbO
2和浓盐酸混合;⑤KClO
3和浓盐酸混合共热;⑥KMnO
4和浓盐酸混合.
A.①④⑤B.①②④⑤C.①③④⑤⑥D.全部可以
(3)某学习小组利用漂白粉与浓硫酸加热也得到了Cl
2,他们用此反应原理设计了如下图所示装置制取氯气并探究其性质.
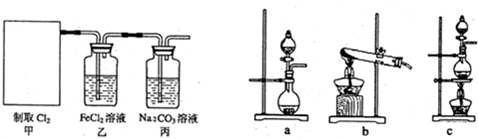
①甲部分的装置是
(填字母);其中的反应方程式:
;
②证明乙装置中FeCl
2发生了氧化反应的实验方法是
;
③丙装置中通入少量Cl
2,可制得某种生活中常用的漂白、消毒的物质.已知相同条件下HClO的电离程度大于HCO
3-,则丙中反应的化学方程式是
;
④该实验存在明显的缺陷,改进的方法是
.
(4)为测定漂白粉中Ca(ClO)
2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H
2SO
4、过量KI溶液,完全反应后,再滴入0.1mol?L
-1 Na
2S
2O
3溶液:2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI,共消耗20mL Na
2S
2O
3溶液,则漂白粉中Ca(ClO)
2的质量分数为
.

 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸: