
题目列表(包括答案和解析)



| ||
| 高温高压 |
| ||
| 高温高压 |
(9分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为 。
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为 。
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为 。
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法 。X转化为Y的化学方程式为 。
(9分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
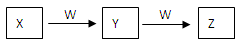
(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为 。
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为 。
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为 。
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法 。X转化为Y的化学方程式为 。
(9分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系: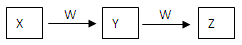
(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为 。
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为 。
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为 。
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法 。X转化为Y的化学方程式为 。
从海水中提取镁,需要在海水中加碱[Mg2++2OH-===Mg(OH)2↓],沉淀经分离后转化为氯化镁[Mg(OH)2+2H+===Mg2++2H2O],最后电解得到金属镁[MgCl2(熔融)![]() Mg+Cl2↑],下列说法中正确的是( )
Mg+Cl2↑],下列说法中正确的是( )
A.电解氯化镁的过程是氧化还原反应
B.将沉淀转化为氯化镁的过程,是镁原子失电子转化为Mg2+的过程
C.电解得到金属镁的过程能写出离子方程式,但不是氧化还原反应
D.Mg在CO2中燃烧的反应可以改写为离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com