
题目列表(包括答案和解析)

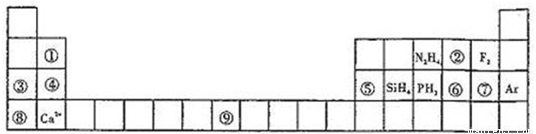
项目 | 同周期(左→右) | 同主族(上→下) | |
原子结构 | 核电荷数 | 逐渐__________ | 逐渐__________ |
电子层数 | __________ | 逐渐__________ | |
原子半径 | 逐渐__________ | 逐渐__________ | |
性质 | 化合价 | 最高正价由__________,负价数=__________ | 最高正价、负价数相同最高正价=__________ |
元素原子的得电子能力和失电子能力 | 失电子能力逐渐__________ 得电子能力逐渐__________ | 失电子能力逐渐__________ 得电子能力逐渐__________ | |
单质的氧化性、还原性 | 还原性__________ 氧化性__________ | 氧化性__________ 还原性__________ | |
最高价氧化物对应的水化物的酸碱性 | 碱性__________ 酸性__________ | 酸性__________ 碱性__________ | |
气态氢化物稳定性 | __________ | __________ | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com