
题目列表(包括答案和解析)
下列方法可用于制备卤化氢的是 ( )
A.食盐和浓HNO3共热制HCl B.NaF和浓H2SO4共热制HF
C.NaBr和浓H3PO4共热制HBr D.KI和浓H2SO4共热制HI
A.食盐和浓HNO3共热制HCl B.NaF和浓H2SO4共热制HF
C.NaBr和浓H3PO4共热制HBr D.KI和浓H2SO4共热制HI
A.食盐和浓HNO3共热制HCl B.NaF和浓H2SO4共热制HF
C.NaBr和浓H3PO4共热制HBr D.KI和浓H2SO4共热制HI
| A、卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 | B、卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小 | C、卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 | D、卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
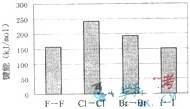 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com