下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期 |
IA |
|
0 |
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为
Na>Al>O
Na>Al>O
(用元素符号表示).
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.
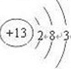
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:

或


或

.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a
a
.
a.MnO
2 b.AlCl
3 c.Na
2SO
3 d.KMnO
4(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为
.
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN
2完全反应转化为NH
3共
放出
放出
(填“吸收”或“放出”)能量
92
92
kJ.


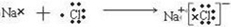
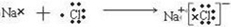
 或
或
 或
或
