
题目列表(包括答案和解析)
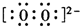
 C2D4(g)达到平衡状态的标志是
C2D4(g)达到平衡状态的标志是 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.科学家利用Na2CO3溶液喷淋捕捉空气中CO2,设计技术流程如图1:

请回答下列问题:
(1)Na2CO3溶液喷成雾状的目的是____ 。
(2)在500℃的反应炉中发生反应的化学方程式为 。
(3)在整个流程中,可以循环利用的物质是 。
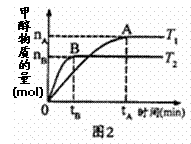 (4)为研究合成塔反应最佳条件,在10 L密闭
(4)为研究合成塔反应最佳条件,在10 L密闭
容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①对于图2实验结果(注:T1、T2均大于300℃)
说法正确的是__________(填序号)。
a.向密闭容器中不断补充CO2,H2转化率增大
b.该反应在T1时的平衡常数比T2时小
c.温度为T1时,从反应开始到平衡,H2平均速率为![]()
d.平衡处于A点时密闭容器温度从T1变到T2,![]() 增大
增大
 ②300℃时,若充人1 mol CO2和
②300℃时,若充人1 mol CO2和
3 mol H2,从反应开始到平衡,测得CO2的转化率为75%。则平衡常数K为
(用最简分数表示)。
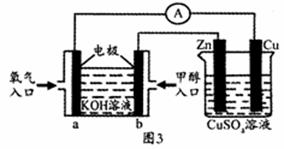
(5)将制备的甲醇(CH3OH)用于图3装置,其中b电极上发生反应的电极反应式为 ;
当铜片质量变化19.2 g时,a极上消耗的O2在标准状况下的体积为__ _L。
把四氧化三铁与焦炭混合后隔绝空气加热,生成物分别可能为FeO、Fe,CO、CO2。
(1)写出四氧化三碳与碳反应生成物都是低价氧化物的化学反应式: 。
若按此反应进行还原1mol四氧化三铁,固体物质的质量减少 g.
(2)分别取116g四氧化三铁,加入足量的碳粉加热反应后产物分别如下表ABCD所列:
| 编号 | 产物 |
| A | FeO CO2 |
| B | FeO CO |
| C | Fe CO2 |
| D | Fe CO |
反应中生成气体在标准状况下的最大体积为 L,固体减少的质量最小为 g。
(3)与1mol四氧化三铁作用,从反应开始至反应结束消耗碳的质量mC的可能的范围为 。
(4)如果反应中产生的气体只有CO2,反应作用掉的碳的质量为Xg,则反应生成的固体产物m的取值范围为(用含X的函数表示) 。
(5)如果反应中生成的都是铁,测得反应产生的气体的密度折算到标准状况下为1.429g/L,反应中固体质量减小256g,则反应中生成铁的质量为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com