
题目列表(包括答案和解析)
| ① | ⑩ | ② | ③ | ||||||||||||||
| ④ | ⑤ | ⑦ | ⑧ | ⑨ | |||||||||||||
| ⑥ | |||||||||||||||||




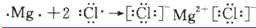
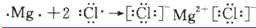


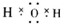
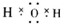
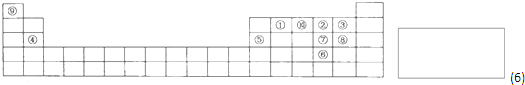
(24分)下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
|
|
|
| |||||||||||||||
|
|
|
|
| ① | ⑩ | ② | ③ |
| |||||||||
|
| ④ | ⑤ |
|
| ⑦ | ⑧ | ⑨ | ||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴在这10种元素中,原子半径较小的是________(填元素符号),化学性质最不活泼的元素是_____(填“元素符号”);其中一种核素可测定文物年代,这种核素的符号是 。
⑵元素①的原子结构示意图为__________;元素①的最高价氧化物结构式为:________,元素⑩的单质电子式为:__________。
请用电子式表示化合物④和⑧的形成过程
________________________________________________。
⑶元素⑤的氧化物与盐酸反应的离子方程式为: _________________________________。
元素⑤的单质与氢氧化钠溶液反应的化学方程式为: ________________________________。
⑷元素⑤的单质与Fe和稀硫酸构成原电池,试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出负极的电极反应为___________________________。
(5)元素⑧单质能溶于水,水液呈 色,在其中通入元素⑦的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。
(6)元素⑦的最高正价和最低负价分别为 、 ,在一定条件下,元素⑦与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下元素⑥与H2反应的限度(选填“更大”、“更小”或“相同”) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com