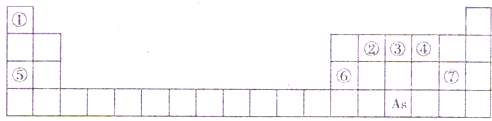
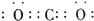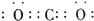下表是元素周期表的一部分,、A、B、C、D、E、X、Y是下表中给出元素组成的常见单质或化合物.
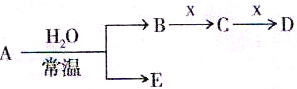
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为氧化物,则 A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.
①当X是碱性盐溶液,C分子中有22个电子时,则X呈碱性的离子方程式为
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
Fe+4H++NO3-═Fe3++NO↑+2H2O
Fe+4H++NO3-═Fe3++NO↑+2H2O
.
(2)若E为单质气体,D为白色沉淀,A的化学式可能是(填两种)
Na、Na2O2或NaH
Na、Na2O2或NaH
,B含有的化学键类型为
离子键和极性共价键
离子键和极性共价键
,C与X反应的离子方程式为
3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
CO+H2O?CO2+H2
CO+H2O?CO2+H2
.
II.元素周期表是人们研究物质性质的重要工具.
(1)As的原子结构示意图
.其氢化物的化学式
AsH3
AsH3
.
(2)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As的最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
.当消耗1mol还原剂时,电子转移了
5
5
mol.