
题目列表(包括答案和解析)
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
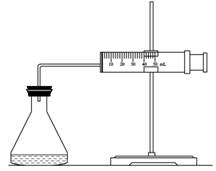
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2++ O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O。
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
|
实验编号 试剂 |
A |
B |
C |
|
10% H2O2/mL |
20.0 |
V1 |
V2 |
|
2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
|
H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O。
 ?
?| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 黄绿 黄绿 色 |
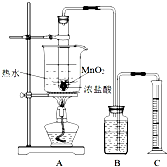 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
实验室中盐酸的用途十分广泛,常常用来制备气体。
(1)某小组同学欲用4 mol/L的盐酸配制230 mL 0.4mol/L 盐酸溶液,需取用4 mol/L盐酸 mL,实验中需要用到的玻璃仪器有 、 、量筒、 烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)(16分)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。( 3Cl2+6KOH ![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
 |
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式 。
(2) 反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
(4)请在装置图方框中画出缺少的实验装置,并注明试剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com