
题目列表(包括答案和解析)
| ||
| ||
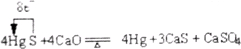
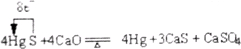
反应Ⅰ HgS+O2![]() Hg+SO2
Hg+SO2
反应Ⅱ 4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
请试完成下列问题:
(1)HgS与氧气反应,氧化剂是______________。
(2)请标出反应Ⅱ中电子转移的方向和数目:______________。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式:__________________________________________。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg+Hg2+![]()
![]() ,提高
,提高![]() 浓度的方法是______________。
浓度的方法是______________。
| |||||||||||||||||||
| ||
| △ |
| M1 |
| M2 |
| ||
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com