
题目列表(包括答案和解析)
工业生产纯碱的过程如下:

完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B的化学式为 。
(2)实验室模拟由滤液制备滤渣的装置如下:

①图1中装置和图2中装置的连接方法为a接 ,b接 ,f接c。
②图2中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)操作⑤煅烧后的纯碱中含有未分解的碳酸氢钠。某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为 。
(4)现有25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是 (填代号)。
a.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3·H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式 。你认为较合理的途径是 (填①或②),理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了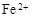 和
和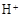 外,还可能存在
(用离子符号表示),检测该离子的方法是
。
外,还可能存在
(用离子符号表示),检测该离子的方法是
。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下: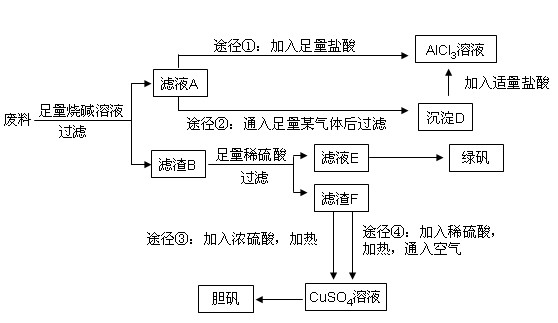
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式 。你认为较合理的途径是 (填①或②),理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了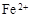 和
和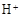 外,还可能存在 (用离子符号表示),检测该离子的方法是 。
外,还可能存在 (用离子符号表示),检测该离子的方法是 。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。

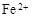 和
和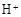 外,还可能存在 (用离子符号表示),检测该离子的方法是 。
外,还可能存在 (用离子符号表示),检测该离子的方法是 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com