
题目列表(包括答案和解析)
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。

(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义
(1)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中加入0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答) ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是 (填序号)。
A.BaO2 + H2SO4= BaSO4 ↓ + H2O2
B.2NH4HSO4 (NH4)2S2O8 +
H2↑
(NH4)2S2O8 +
H2↑
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
D.乙基蒽醌法见下图

(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L―1的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是 (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。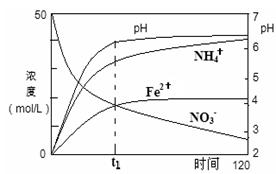
(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com