
题目列表(包括答案和解析)
下列离子方程式书写正确的是
A.Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
B.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.氢氧化钡溶液与稀硫酸: Ba2++ OH- + H+ + SO42-= BaSO4↓ + H2O
D.醋酸与氢氧化钠溶液的反应 H+ + OH-=H2O
【解析】次氯酸钙具有强氧化性,能氧化SO2,生成硫酸,B不正确。C中不符合物质定比组成,正确的应是Ba2++ 2OH- +2 H++ SO42- = BaSO4↓+ 2H2O,C不正确。醋酸是弱电解质,用化学式表示,所以正确的答案是A。
下列离子方程式书写正确的是
A.Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+ 2H2O
B.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.氢氧化钡溶液与稀硫酸: Ba2++ OH- + H+ + SO42- = BaSO4↓ + H2O
D.醋酸与氢氧化钠溶液的反应 H+ + OH-=H2O
【解析】次氯酸钙具有强氧化性,能氧化SO2,生成硫酸,B不正确。C中不符合物质定比组成,正确的应是Ba2++ 2OH- +2 H+ + SO42- = BaSO4↓ + 2H2O,C不正确。醋酸是弱电解质,用化学式表示,所以正确的答案是A。
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度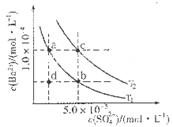
| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度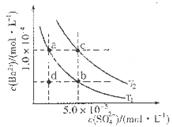
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
|
电解质 |
电离方程式 |
电离常数K |
Ksp |
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
- |
|
C6H5OH |
C6H5OH |
1.1×10-10 |
- |
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
- |
|
BaSO4 |
BaSO4(s) |
- |
1.07×10-10 |
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
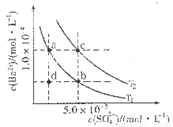
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com