
题目列表(包括答案和解析)
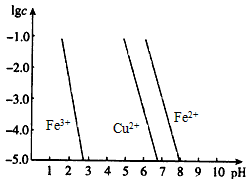
将Zn、Cu混合粉末投入含有FeCl3、FeCl2、CuCl2的混合溶液中,充分反应后,据此回答下列问题(填金属和金属阳离子):
(1)若容器内有Zn剩余,则剩余固体中还有________;溶液中的金属离子为________;
(2)若溶液中含有Fe3+,溶液中的金属阳离子为________;
(3)若溶液中含有Cu2+,剩余固体中含有铜,则溶液中还存在的金属阳离子有________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com