
题目列表(包括答案和解析)
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是________.
②杂质铁与足量稀硝酸反应的离子方程式为________.在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在________范围.
不用加水的方法调节溶液pH的原因是________.
③最后一步所得晶体应采用少量95%酒精淋洗后晾干.用酒精淋洗的优点是________.
(2)下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是________(填字母).

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离.由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.Cu与液态N2O4反应制得无水硝酸铜的化学方程式是________.
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 生成物中含水溶性铜化合物的百分含量/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 生成物中含酸溶性铜化合物的百分含量/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4?5H2O | 23.1 | 32.0 | 44.6 | 61.8 | 83.8 | 114.0 |
| Cu(NO3)2?xH2O | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| CuSO4?5H2O | 23.1 | 32.0 | 44.6 | 61.8 | 83.8 | 114.0 |
| Cu(NO3)2?xH2O | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是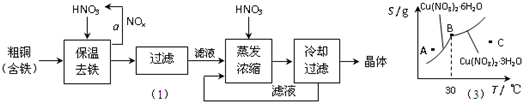
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com