
题目列表(包括答案和解析)
(1)SO2是重要的大气污染物,大量SO2主要来源 。
(2)SO2本身不断污染大气,它在大气中经尘粒催化,与水、氧气作用,形成危害更大的酸雨,形成酸雨的有关化学反应方程式为 。
(3)某地酸雨经检验含:Na+2.3×10-5mol·L-1、Cl-3.5×10-5mol-1、NH![]() 7.0×10-6mol·L-1,则该酸雨的pH为多少?
7.0×10-6mol·L-1,则该酸雨的pH为多少?
(4)火力发电厂燃烧煤的废气中往往含有SO2,为了除去有害气体SO2,并变废为宝,常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏,请回答:
①写出上述反应的化学方程式:SO2和CaCO3、悬浊液反应 ;SO2和Ca(OH)2悬浊液 。
②试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由。
(5)某地酸雨,每隔一定时间测定其pH。发现pH逐渐变大,其原因是 。
(2)SO2本身不断污染大气,它在大气中经尘粒催化,与水、氧气作用,形成危害更大的酸雨,形成酸雨的有关化学反应方程式为 。
(3)某地酸雨经检验含:Na+2.3×10-5mol·L-1、Cl-3.5×10-5mol-1、NH![]() 7.0×10-6mol·L-1,则该酸雨的pH为多少?
7.0×10-6mol·L-1,则该酸雨的pH为多少?
(4)火力发电厂燃烧煤的废气中往往含有SO2,为了除去有害气体SO2,并变废为宝,常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏,请回答:
①写出上述反应的化学方程式:SO2和CaCO3、悬浊液反应 ;SO2和Ca(OH)2悬浊液 。
②试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由。
(5)某地酸雨,每隔一定时间测定其pH。发现pH逐渐变大,其原因是 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
下列措施中能提高燃煤烟气中去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=_________;用O2的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A. B.容器内压强保持不变.
B.容器内压强保持不变.
C. D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染, 请写出CH4与NO反应的化学方程式:_________;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应)。
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应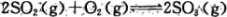 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=_________;用O2的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A. B.容器内压强保持不变.
B.容器内压强保持不变.
C.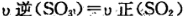 D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染, 请写出CH4与NO反应的化学方程式:_________;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com