
题目列表(包括答案和解析)
有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,发生的反应为 [Al(OH)4]― + CO2+ H2O ═ Al(OH)3↓ + HCO3― 将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为 。
(2)小青取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m2的取值范围是 。(2分)
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,发生的反应为 [Al(OH)4]― + CO2+ H2O ═ Al(OH)3↓ + HCO3― 将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为 。
(2)小青取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m2的取值范围是 。(2分)
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
|
实验序号 |
a |
b |
c |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
560 |
672 |
672 |
求:(ⅰ)盐酸的物质的量浓度;
(ⅱ)合金中镁的质量分数;
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
(13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是 (填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g) 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。
CO2(g)+H2(g)的焓变(△H)为 。
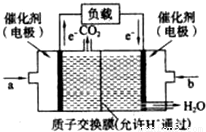
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
 ①a处通入的是
(填物质名称),左侧电极上发
①a处通入的是
(填物质名称),左侧电极上发
生 (填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从 到
(填“左”或“右”)
③该电池正极反应式为 。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH= 。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:

①在实验1中,以v(CO2)表示该反应的反应速率为 mol·L-1·min-1;
②在实验2中,t 5。(填“>”、“<”或“=”)
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 2 | 4 | 0.9 | t |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com