
题目列表(包括答案和解析)
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中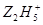 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,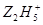 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中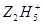 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,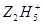 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
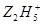 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,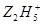 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
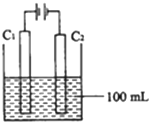
(18分)X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子数的2倍、Z元素是植物生长的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素:X________,Y_________,Z__________(写元素符号)。
(2)Y元素的单质中有一种称为足球稀的分子Y![]() ,它可能最易发生的反应是______。
,它可能最易发生的反应是______。
![]() A.消去反应 B.取代反应 C.加成反应 D.聚合反应
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)Z与X可形成多种化合物,其中ZX![]() 的电子式为________________。(用推断出的X、Z的元素符号表示)
的电子式为________________。(用推断出的X、Z的元素符号表示)
(4)最近科学家们合成了由Z元素形成的Z![]() ,电子式为
,电子式为![]()
则n值____________________。
(5)Z的最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。
①甲的浓度溶液与Y元素的单质共热的化学反应方程式为_____________________。
②丙对水的电离起____________作用(填“抑制”、“促进”或“不影响”),原因是(用离子方程式表示)_______________________________;
③在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知![]() ,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是___________(选填字母)
,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是___________(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体的密度
(6)若X的单质的燃烧热为M KJ![]() ,试写出其单质在空气中燃烧的热化学方程式:__________________________。
,试写出其单质在空气中燃烧的热化学方程式:__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com