
题目列表(包括答案和解析)
工业制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶.它的反应原理可以用下面方程式表示:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
以上反应总结果是放热反应.请设计一个实验,用最简单的实验装置模拟实现这一过程,获得NaHCO3结晶.可供选择的实验用品有:20%的盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水、冰,以及中学化学常用仪器.
(1)画出实验装置示意图(包括反应时容器中的物质),并在图中玻璃容器旁自左至右分别用A、B、C、…符号标明.所有仪器的简要画法请见下面的两点说明.

②铁架台、石棉网、酒精灯、玻璃导管之间的联接等,在示意图中不必画出.如需加热,可在需加热的仪器下方标出“△”表示.
(2)写出上图中用A,B,C,…各玻璃容器中盛放的物质的化学式或名称.
(3)利用本题所提供的实验用品,判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶.
(15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:
请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
(15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下: 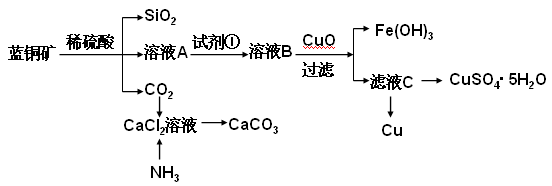
请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。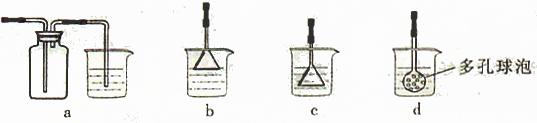
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
(15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:

请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。
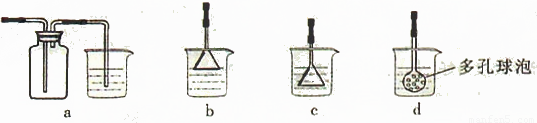
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:

请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。
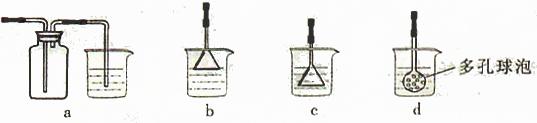
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com