碳元素的化合物如甲烷、碳酸钙在自然界储量丰富,分布广泛,有非常重要的用途.
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH
4(g)+H
2O(g)?CO(g)+3H
2(g).
已知温度、压强和水碳比[n(H
2O)/n(CH
4)]对甲烷平衡含量的影响如下图:
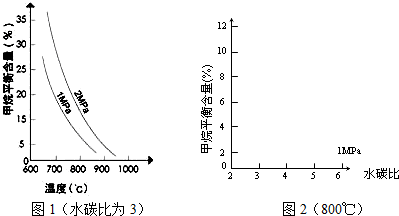
(1)温度对该反应的反应速率和平衡移动的影响是
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
.
(2)其他条件不变,请在图2中画出压强为2MPa时,CH
4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH
4与一定量H
2O在1L的密闭容器中反应,6分钟达到平衡,此时CH
4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H
2)为
0.4 mol/(L?min)
0.4 mol/(L?min)
;此条件下该反应的热化学方程式为
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
.
(4)CaCO
3是一种难溶物,其K
sp=2.8×10
-9.现将 amol/L的CaCl
2溶液与2.0×10
-4mol/L Na
2CO
3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO
3沉淀,则a的最小值为
5.6×10-5
5.6×10-5
mol/L.

