1、亚氯酸钠(NaClO
2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
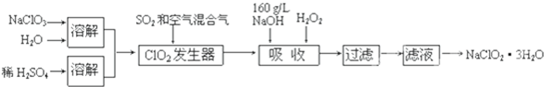
已知:①NaClO
2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO
2?3H
2O.
②纯ClO
2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g/L NaOH溶液的物质的量浓度为:
4.00 mol/L
4.00 mol/L
(结果保留三位有效数字)
(2)发生器中鼓入空气的作用是:
稀释ClO2,防止ClO2分解爆炸
稀释ClO2,防止ClO2分解爆炸
.
(3)吸收装置内发生反应的化学方程式为:
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
;
吸收装置中的温度不能过高,其原因是:
防止H2O2的分解
防止H2O2的分解
.
(4)吸收塔中为防止NaClO
2被还原成NaCl,所用还原剂的还原性应适中.除H
2O
2外,还可以选择的还原剂是
a
a
(选填序号)a.Na
2O
2 b.Na
2S c.FeCl
2(5)从滤液中得到NaClO
2?3H
2O粗晶体的实验操作依次是
b e d
b e d
(选填序号)
a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
2、在氯氧化法处理含CN
一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg?L
-1.现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl
2=KOCN+2KCl+H
2O,再投入过量液氯,可将氰酸盐进一步氯化为氮气.请配平下列化学方程式:
(配平后请在方框内填写每种物质的化学计量数,若为“1”也要写上)
2
2
KOCN+
4
4
KOH+
3
3
Cl
2→
2
2
CO
2+
1
1
N
2+
6
6
KCl+
2
2
H
2O
(2)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
35.5
35.5
g.


 (2012?丹东模拟)为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(2012?丹东模拟)为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案: