
题目列表(包括答案和解析)
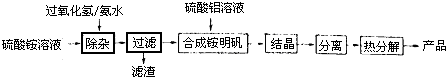
| ||
| 加热 |
| ||
| 加热 |

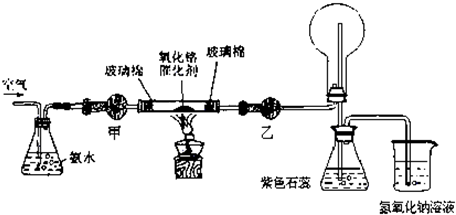
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。
(1)A中的化学反应方程式: 。
(2)A装置还可用于制取气体 (只填一种)
(3)若有21.4gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
(8)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3))
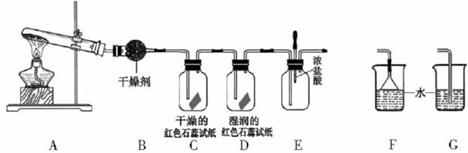
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。
(1)A中的化学反应方程式: 。
(2)A装置还可用于制取气体 (只填一种)
(3)若有21.4gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
(8)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物)
B.NaOH 固体
C.硫酸溶液
D.石灰石(含CaCO3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com