
题目列表(包括答案和解析)
| A、向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色 | B、纯净的氢气在氯气中安静地燃烧,发出苍白色火焰 | C、漂白粉的有效成分是CaCl2和Ca(ClO)2,应密闭保存 | D、在氯气泄漏时,可以用浸有NaOH水溶液的毛巾捂住口鼻,并向下风方向跑 |
| ||
| ||
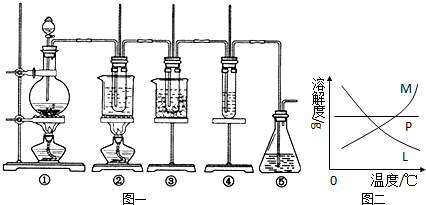
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。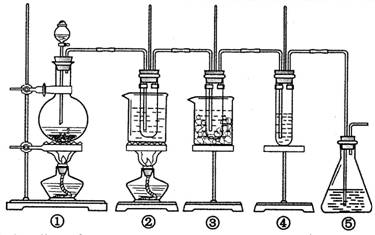
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
A.NaBiO3 B.FeCl3 C.PbO2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;② 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 。为什么? 。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量 。
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是: 。A.NaBiO3 B.FeCl3 C.PbO2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
 (3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ; ② 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 。为什么? 。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量 。
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com