
题目列表(包括答案和解析)
参考下列①~③项回答问题。
①皂化值是使1g油脂皂化所需要的氢氧化钾的毫克数。
②碘值是使100g油脂加成时消耗单质碘的克数。
③各种油脂的皂化值、碘值列表如下:
花生油 亚麻仁油 牛油 黄油 硬化大豆油 大豆油
皂化值 190 180 192 226 193 193
碘 值 90 182 38 38 5 126
(1)单纯油(C17H33COO)3C3H5(相对分子质量884)形成的油,用氢氧化钾皂化时,皂化值为__________,写出其反应方程式:________________________________。
(2)在下列①~③的括号内填入适当的词句。
①亚麻仁油比花生油所含的________多;
②黄油比牛油所含的_________多;
③硬化大豆油的碘值小的原因是_____________。
(3)为使碘值为180的100g鱼油硬化,所需的氢气的体积在标准状况下为多少升?
(4)用下列结构式所代表的酯,若皂化值为430,求n为多少?并完成下面反应方程式:
![]()
①皂化值是使1g油脂皂化所需要的氢氧化钾的毫克数。
②碘值是使100g油脂加成时消耗单质碘的克数。
③各种油脂的皂化值、碘值列表如下:
花生油 亚麻仁油 牛油 黄油 硬化大豆油 大豆油
皂化值 190 180 192 226 193 193
碘 值 90 182 38 38 5 126
(1)单纯油(C17H33COO)3C3H5(相对分子质量884)形成的油,用氢氧化钾皂化时,皂化值为__________,写出其反应方程式:________________________________。
(2)在下列①~③的括号内填入适当的词句。
①亚麻仁油比花生油所含的________多;
②黄油比牛油所含的_________多;
③硬化大豆油的碘值小的原因是_____________。
(3)为使碘值为180的100g鱼油硬化,所需的氢气的体积在标准状况下为多少升?
(4)用下列结构式所代表的酯,若皂化值为430,求n为多少?并完成下面反应方程式:
![]()
有X、Y、Z三种盐,已知:①25℃,X的饱和溶液中溶质的质量分数为15%;②25℃时,在100g浓度为10%的Y溶液中加入5gY(无水盐)后,恰好达到饱和;③25℃时,将一定量的Z溶液蒸发掉5.75g水再恢复到25℃,或保持25℃向其中加入6.3gZ的结晶水合物Z·9![]() (相对分子质量为240),都恰好形成饱和溶液.则25℃时,X、Y、Z的溶解度(均指无水盐)大小顺序正确的是
(相对分子质量为240),都恰好形成饱和溶液.则25℃时,X、Y、Z的溶解度(均指无水盐)大小顺序正确的是
[ ]
A.![]() B.
B.![]()
C.![]() D.
D.![]()
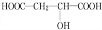 +HCOOH
+HCOOH| 浓硫酸 |
| △ |
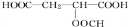 +H2O
+H2O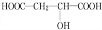 +HCOOH
+HCOOH| 浓硫酸 |
| △ |
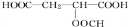 +H2O
+H2O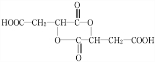




| 氢氧化物开始沉淀时的PH | 氢氧化物沉淀完全时的PH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 |
溶液出现血红色,则绿色溶液C仍有Fe3+ 溶液出现血红色,则绿色溶液C仍有Fe3+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com