
题目列表(包括答案和解析)
(1)最新研制的一种新型乙醇电池示意图如右,
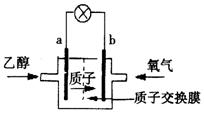
电池的两极分别充入乙醇和氧气,用酸类离子作溶剂。则电池工作时 (选填a或b)为负极,b极的电极反应式为 ______________
(2)欲在某镀件上镀银,将银片和待镀镀件分别做两极,插入加入电镀液(含AgNO3溶液)的大烧杯中。其中待镀的镀件做 _______ 极。接通直流电源后几分钟,就看到镀件的表面镀上了一层银。银电极发生 _____________ 反应。
(3)铅蓄电池是最常见的二次电池,它由两组栅状极板交替排列而成,极板上分别覆盖有Pb和PbO2,电解质是H2SO 4溶液。
① 铅蓄电池放电时,其中一个电极的反应如下:
PbO2 + 4H+ + SO42- +2e- === PbSO4 + 2H2O
另一个电极的反应为
② 铅蓄电池充电时,总反应的化学方程式为
③若使用铅蓄电池作电源,用惰性电极电解足量CuCl2溶液。若在阳极上析出气体体积为44.8 L(标准状况下),则阴极质量变化________________ ,铅蓄电池中参加反应的H2SO 4的物质的量为
a、b、c是原子序数依次增大的三种常见短周期元素,由a、b、c三元素组成的化合物甲的用途如下图所示。a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种。化合物甲、乙、丙、丁、戊之间也能相互反应。已知乙、戊分别是由a、b两元素按原子个数1∶1和2∶1组成的化合物。若a、b、c三元素形成的单质和由它们组成的化合物之间的反应关系如下(未配平)
①b2+c→丙(条件点燃) ②a2+c→丁 ③乙+丙→甲 ④丙+丁→ c+戊
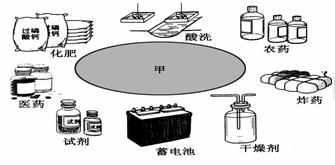
甲的用途
试解答下列问题:
(1)写出下列物质的化学式:
甲:__________;丙:__________;丁:__________。
(2)写出下列反应的化学方程式:
反应①:____________________________________________________________;
反应④:____________________________________________________________。
(3)乙的结构式是__________;实验测得化合物乙和化合物戊能以任意比相溶,根据“相似相溶”的经验规律可推测化合物乙是__________分子(填“极性”或“非极性”)。
(4)阅读甲的用途图,回答下列问题:
①实验室用甲作干燥剂,这是利用甲的那一项特性?__________
②试剂厂用甲和Ca3(PO4)2反应制备化学试剂磷酸,在反应中利用了甲的哪一项性质?___________________________
③甲是制造铅蓄电池的重要原料,在铅蓄电池中甲的作用是___________________
 下面是几种常见的化学电源示意图,有关说法不正确的是( )
下面是几种常见的化学电源示意图,有关说法不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com