
题目列表(包括答案和解析)
(10分)一化学研究性学习小组对某工厂利用FeCl3溶液与铜反应制印刷电路板所得废液进行探究。
(1)甲同学取10mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥、称重为8.61g,乙同学另取10mL废液,加入某试剂,将pH调至4.0,产生沉淀,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32g。
已知有关金属离子从开始沉淀到沉淀完全时溶液的pH为:
 Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe2+:7.6~9.6
Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe2+:7.6~9.6
试求:
(1)上述废液中c(Fe3+)、 c(Cu2+)、 c(Fe2+)
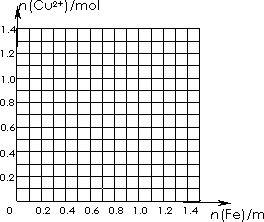
(2)两同学为了从废液中回收铜,取上述1L废液加入铁粉,充分反应。请画出加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用该曲线计算,当铜离子的物质的量减少一半时,加入铁粉的质量为多少克?一化学研究性学习小组对某工厂利用FeCl3溶液与铜反应制印刷电路板所得废液进行探究.
(1)甲同学取10 mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥、称重为8.61 g,乙同学另取10 mL废液,加入某试剂,将pH调至4.0,产生沉淀,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32 g.
已知有关金属离子从开始沉淀到沉淀完全时溶液的pH为:
Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe2+:7.6~9.6
试求:
(1)上述废液中c(Fe3+)、c(Cu2+)、c(Fe2+)
(2)两同学为了从废液中回收铜,取上述1 L废液加入铁粉,充分反应.请画出加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用该曲线计算,当铜离子的物质的量减少一半时,加入铁粉的质量为多少克?
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
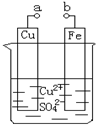 (2012?房山区二模)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
(2012?房山区二模)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com