
题目列表(包括答案和解析)
| 65×(V2+V3)×10-3 |
| 22.4×m |
| 65×(V2+V3)×10-3 |
| 22.4×m |

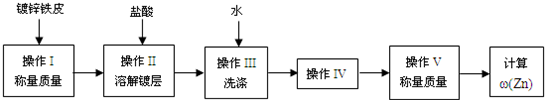
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁条(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁条浸入酸中至反应完全;
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法:_____________________。
(2)量取10.00 mL1mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是_________(填下列各项序号字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁条质量不能少于_________ g。
(4)步骤⑤中需记录的数据是_______;实验过程中观察到的主要现象是______________。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为_________(填“偏大”“偏小”或“无法确定”)。
(6)为保证实验顺利进行,仪器丙应选用的规格是_________(填序号字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为______ L·mol-1。
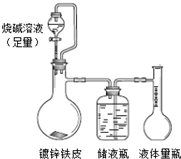
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽 、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□ 。若该实验生成的 C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。

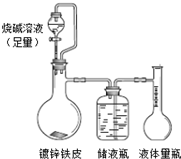
某研究性学习小组为探究在相同条件下,同浓度同体积的一元强酸和弱酸分别与同种金属反应时生成氢气的速率是否相同,组装了两套如下图所示的简易实验装置.该装置同时还可测定该温度和压强下的气体摩尔体积.
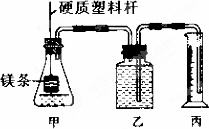
该实验的主要操作步骤如下∶
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.0 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全,记录反应的起止时间.
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL.
请根据上述步骤回答下列问题∶
(1)步骤④中,理论上称取的镁带质量不能少于________g.
(2)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为________L·mol-1.
(3)实验过程中观察到的主要现象是∶盛________(填“盐酸”或“醋酸”)的锥形瓶中反应更剧烈,反应完全用时较少;与足量镁带反应完全最终排出水的体积________(填序号字母).
A.盐酸更多
B.醋酸更多
C.一样多
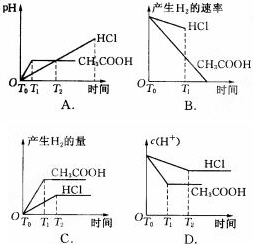
(4)如果将上述实验改为∶在体积均为1 L,pH都等于2的盐酸和醋酸溶液中,分别投入0.65 g锌粒,则下图所示比较符合客观事实的是________(填序号字母).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com