
题目列表(包括答案和解析)
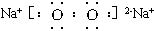
(1)A的化学式为____________________。
(2)N的电子式为____________________,所含化学键为____________________。
(3)A→C的离子方程式为________________________________。
(4)C→D的化学方程式为________________________________。
(5)已知标准状况下有
【12分】下列物质均为中学化学常见的物质,其转化关系如图所示,反应条件及部分产物未全部标出。已知A为正盐,试剂①和试剂②为中学化学实验室常用的试剂,其中B、C、D、E、G常温下为气体,H常温下为液体。
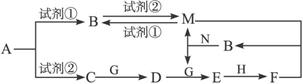
(1)A的化学式为____________________。
(2)N的电子式为____________________,所含化学键为____________________。
(3)A→C的离子方程式为________________________________。
(4)C→D的化学方程式为________________________________。
(5)已知标准状况下有33.6 L的C与G完全反应生成D,则转移的电子数为_______NA。
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
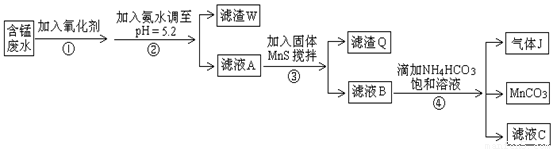
已知某些物质完全沉淀的pH值如下表:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
Mn(OH)2 |
CuS |
MnS |
MnCO3 |
|
沉淀完全时的PH |
3.7 |
5.2 |
6.4 |
9.8 |
≥0 |
≥7 |
≥7 |
回答下列问题:
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是 。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是 。
(3)过程③中,搅拌的目的是 ,发生反应的离子方程式是 。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 + O2
→ MnO2 + CO2。
O2
→ MnO2 + CO2。
现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)
下列物质均为中学化学常见的物质,其转化关系如图所示,反应条件及部分产物未全部标出。已知A为正盐,试剂①和试剂②为中学化学实验室常用的试剂,其中B、C、D、E、G常温下为气体,H常温下为液体。
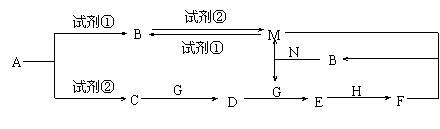 (1)A的化学式为 。
(1)A的化学式为 。
(2)N的电子式为 ,所含化学键为 。
(3)A→C的离子方程式为 。
(4)C→D的化学方程式为 。
(5)已知标准状况下有33.6L的C与G完全反应生成D,则转移的电子数为 NA。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com