
题目列表(包括答案和解析)
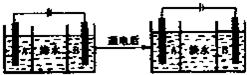 (2013?泰安二模)处理主要包括水的净化、污水处理、硬水软化和海水淡化等.
(2013?泰安二模)处理主要包括水的净化、污水处理、硬水软化和海水淡化等.
 (X代表卤原子)
(X代表卤原子) +
+
| 浓硫酸 |
| △ |
 +H2O
+H2O +
+
| 浓硫酸 |
| △ |
 +H2O
+H2O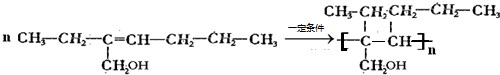
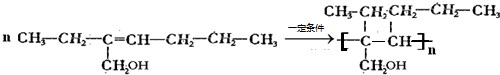


| 实验步骤 | 预期现象和结论 | ① | 取少量上述漂白粉于试管中, 加入足量1mol.L-1的HCl,并将产生的气体导入澄清石灰水中 加入足量1mol.L-1的HCl,并将产生的气体导入澄清石灰水中 . |
(1)若澄清石灰水 若澄清石灰水未变浑浊 若澄清石灰水未变浑浊 ,则样品中不含碳酸钙 样品中不含碳酸钙 ;(2)若澄清石灰水 若澄清石灰水 变浑浊 若澄清石灰水 变浑浊 ,则样品中含有碳酸钙 样品中含有碳酸钙 |
② | 向实验①后的试管中滴入 几滴品红溶液,振荡 几滴品红溶液,振荡 . |
若 若品红褪色,则样品中含Ca(ClO)2 若品红褪色,则样品中含Ca(ClO)2 ;若 若品红不褪色,则样品中不含Ca(ClO)2 若品红不褪色,则样品中不含Ca(ClO)2 ; |
(9分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。
请回答下列问题。
(1)对NO的叙述正确的是________(填序号)。
A.NO是一种无色有毒的气体 B.常温、常压下,NO难与空气中的O2化合
C.含等质量氧元素的NO和CO的物质的量相等 D.NO易溶于水,不能用排水法收集
(2)NO对环境的危害在于________(填序号)。
A.破坏臭氧层 B.高温下能使一些金属被氧化 C.造成酸雨 D.与人体血红蛋白结合
(3)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式为:_________________________________________。
(4)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:___________________________________________。
(5)解释变化(4)中为什么最后的气体总压力小于原压力的2/3?
________________________________________________________________________
________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com