
题目列表(包括答案和解析)
| ||
(1)工业高炉炼铁采用焦炭、铁矿石等于高炉中共热,并鼓入适量空气,让高温下产生的CO气体还原铁矿石制得铁。这种方法不可避免地混入了非金属单质——碳。纯铁的抗腐蚀能力相当强,而铁碳合金却易发生电化腐蚀。
①写出钢铁发生吸氧腐蚀时的正极反应____________________________________。
②为保护钢铁制品不被腐蚀,可采用的电化学防护方法是(答出一种电化学防护方法的名称)____________________________________。
(2)焊接无缝钢轨时常采用铝热反应制备铁,中学教材中也有Al和Fe2O3的铝热反应实验。
①有人推测,铝热反应实验中所得熔融物中可能混有Al。若用一个简单实验证明含Al,则应选用的试剂是____________,能证明含铝的现象是__________________________。
②若经实验证实熔融物含铝,欲将该熔融物完全溶解,下列试剂中最适宜的是____________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀HNO3 D.NaOH溶液
③实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,直到还原成铵根离子(![]() )。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:
)。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:

试回答下列问题:
Ⅰ.图中DE段沉淀的物质的量没有变化,此段发生反应的离子方程式为_________________。
Ⅱ.通过图象判断溶液中的离子结合OH-能力最强的是________________,最弱的是________________。
Ⅲ.EF段反应的离子方程式是________________,A与B 的差值是________________mol。
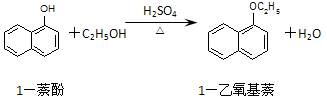

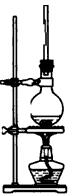
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下:
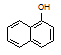 +C2H5OH
+C2H5OH![]()
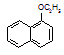 +H2O
+H2O
1-萘酚 1-乙氧基萘
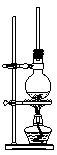
⑴将72 g 1-萘酚溶于100 mL无水乙醇中,加入5 mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 ▲ 。烧瓶上连接长直玻璃管的主要作用是 ▲ 。
⑵反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作: ①蒸馏 ②水洗并分液 ③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 ▲ 。
A.③②④① B.①②③④ C.②①③④
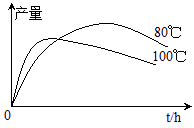 ⑶蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有 ▲ 。
⑶蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有 ▲ 。
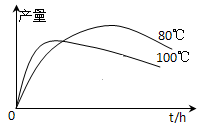
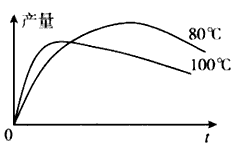
⑷实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高1-乙氧基萘的产量下降的原因可能是 ▲ 、 ▲ 。
⑸用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论: ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com