
题目列表(包括答案和解析)

| ||
| ||
| ||
| △ |
| ||
| △ |
 (2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
(2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下: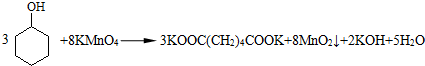
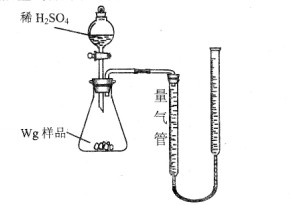
[2012·云南省质检](10分)用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去)。称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解。实验前量气管起始读数为amL,实验后量气管的最终读数为bmL。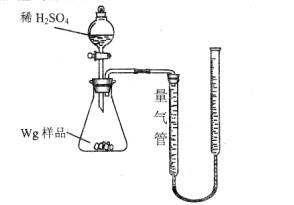
请回答下列问题:
(1)按上图完成装置连接,开始实验前必须进行的操作是 。
(2)写出锥形瓶中发生化合反应的离子方程式: 。
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
| A.盐酸 | B.KSCN溶液 | C.酸性KMnO4溶液 | D.H2O2溶液 |
| 序号 | 溶液中可能存在 的金属离子 | 选择最少种数的试剂,验证该 假设(填字母) |
| ① | | |
| ② | | |
| ③ | | |
 (Fe) (b-a)×10-3L
(Fe) (b-a)×10-3L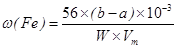
[2012·云南省质检](10分)用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去)。称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解。实验前量气管起始读数为amL,实验后量气管的最终读数为bmL。
请回答下列问题:
(1)按上图完成装置连接,开始实验前必须进行的操作是 。
(2)写出锥形瓶中发生化合反应的离子方程式: 。
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
A.盐酸 B.KSCN溶液 C.酸性KMnO4溶液 D.H2O2溶液
|
序号 |
溶液中可能存在 的金属离子 |
选择最少种数的试剂,验证该 假设(填字母) |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
(4)实验中要对量气管多次读数,读数时应注意:①将实验装置恢复到室温;② ; ③视线与凹液面最低处相平。若读取量气管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响’”)。
(5)若样品与足量稀硫酸反应后滴入KSCN溶液不显红色且量气管读数b>a(该实验条件下的气体摩尔体积为Vm)。下列有关单质铁质量分数的计算过程是否正确? (填“是”或“否”), 理由是 。
Fe+H2SO4=FeSO4+H2↑
56g VmL
Wg×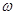 (Fe)
(b-a)×10-3L
(Fe)
(b-a)×10-3L
……
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com