
题目列表(包括答案和解析)
下列离子方程式书写正确的是
A.Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
B.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.氢氧化钡溶液与稀硫酸: Ba2++ OH- + H+ + SO42-= BaSO4↓ + H2O
D.醋酸与氢氧化钠溶液的反应 H+ + OH-=H2O
【解析】次氯酸钙具有强氧化性,能氧化SO2,生成硫酸,B不正确。C中不符合物质定比组成,正确的应是Ba2++ 2OH- +2 H++ SO42- = BaSO4↓+ 2H2O,C不正确。醋酸是弱电解质,用化学式表示,所以正确的答案是A。
下列离子方程式书写正确的是
A.Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+ 2H2O
B.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.氢氧化钡溶液与稀硫酸: Ba2++ OH- + H+ + SO42- = BaSO4↓ + H2O
D.醋酸与氢氧化钠溶液的反应 H+ + OH-=H2O
【解析】次氯酸钙具有强氧化性,能氧化SO2,生成硫酸,B不正确。C中不符合物质定比组成,正确的应是Ba2++ 2OH- +2 H+ + SO42- = BaSO4↓ + 2H2O,C不正确。醋酸是弱电解质,用化学式表示,所以正确的答案是A。
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常温时,有以下3种溶液,其中pH最小的是

⑺ 已知醋酸能![]() 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定![]() 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);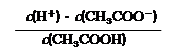
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常温时,有以下3种溶液,其中pH最小的是
⑺ 已知醋酸能够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);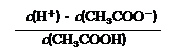
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L;已知:lg1.3=0.114);
⑷对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹常温时,有以下3种溶液,其中pH最小的是
⑺已知醋酸能 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com