
题目列表(包括答案和解析)
用一定方法可除去下列物质中所含的少量杂质(括号内为杂质),其中加适量的盐酸能达到除杂质目的的是( )
A.NaHCO3(Na2CO3) B.NaCl(NaOH)
C.Na2SO4(Na2CO3) D.Na2CO3(NaOH)
用一定方法可除去下列物质所含的少量杂质(括号内为杂质).其中加适量的盐酸能达到除杂目的的是
[ ]
(1)下列实验操作或对实验事实的描述不正确的是________(填序号,错选一个倒扣2分,不出现负分)
①用量筒量得稀硫酸溶液8.0mL;②浓硫酸不小心沾在皮肤上,应立即用大量的水冲洗;③用热的浓HCl洗涤附着有MnO2的试管;④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高;⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;⑥用碱式滴定管量得KMnO4溶液20.50mL;⑦实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;⑧配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(2)有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
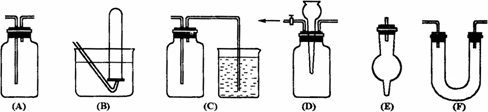
①能用做干燥二氧化硫气体的装置有________;(填代号,下同)
②既能用于收集氯气又能用于收集一氧化氮气体的装置有________;
③在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有________;
若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是________。
(3)学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,想再探究其他一些物质如氧化铝是否也可以作过氧化氢分解的催化剂。请你一起参与他们的探究过程。
①[问题]:Al2O3能不能作过氧化氢分解的催化剂呢?
②[猜想]:Al2O3能作过氧化氢分解的催化剂。
③[实验验证]:

④[结论]:Al2O3能加快过氧化氢分解速率,故Al2O3能作过氧化氢分解的催化剂。
⑤[讨论与反思]:经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢的催化剂,还要补充一个探究实验:
实验三:[实验目的]:探究________。
[实验步骤]:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行过滤、洗涤、________、称量;④对比反应前后Al2O3的质量。
[讨论]:如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究________。

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com