
题目列表(包括答案和解析)
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为 ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为 (用离子符号表示),其中形成的化合物中能发生潮解的是 (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式: 。
②Be(OH)+与强碱溶液反应的离子方程式: 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是 (选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳

 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐

 精盐
精盐

 滤液
滤液
 食盐晶体
食盐晶体
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为 ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为 (用离子符号表示),其中形成的化合物中能发生潮解的是 (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式: 。
②Be(OH)+与强碱溶液反应的离子方程式: 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是 (选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳

 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐

 精盐
精盐

 滤液
滤液
 食盐晶体
食盐晶体
 溴蒸气
溴蒸气
 液溴
液溴 
 石灰乳
石灰乳
 MgO
MgO 镁
镁
 滤液
滤液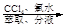 含碘有机溶液
含碘有机溶液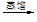 碘晶体
碘晶体
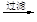
 精盐
精盐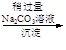
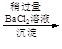
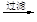 滤液
滤液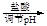
 食盐晶体
食盐晶体铁是人类生产和生活中必不可少的重要金属。

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
铁是人类生产和生活中必不可少的重要金属。
(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com